ハーブ向けの基礎化学(図で見る有機化学)
ハーブ向けの基礎化学
(図で見る有機化学)木陽塾
1) ハーブ向け化学とは
ハーブは、植物のエッセンスオイル(精油)の芳香を楽しみ、ハーブティーとして飲用して楽しめる植物の恵みの集大成です。植物の中のエッセンスは、炭素の化合物の集まりであり、有機物と呼ばれます。化学の中では有機化学という分野で扱います。炭素は、生き物の基本元素です。多様な結合が植物・動物によって作られます。その多種多様な結合によって様々な性質が現れます。その様々な性質を活用することがハーブの本質です。
ハーブを使う癒しは、ハーバルセラピーと呼ばれて欧米では非常に盛んです。中でも香りを楽しむアロマセラピーは近年、日本でも人気を集めています。ハーブでは主に植物のエッセンシャルオイルを対象としているので、有機化学の知識が重要になります。炭素と種々の結合によって香りが生まれます。特に、微量の酸素と結合した炭素が香りを特徴づけます。炭素以外の匂いでは、酸素の仲間のオゾンの匂い。窒素のアンモニア臭が有名です。
2) 有機化学とは炭素(カーボン)を中心として、水素、酸素、窒素などが結びついた化合物の化学です。有機物は、昔は生き物によってしか合成できないと考えられていました。それに対して金属などを非生物の鉱物などの化学を無機化学といいます。現代化学では、有機金属化学の研究が進み、有機と無機化学は融合しています。
3) 炭素とは、元素記号でCと表し、周期律表で6番目の元素です。6つの電子が原子核の周りにありますが、そのうち、4つの結合にかかわる電子をもっているため、4本の結合ができます。元素なかでも炭素だけが、複雑な化合物、つまり有機化合物をつくる能力を持っています。
炭素は様々な元素や官能基と結合する。そのとき、正四面体の中心になるように配置される。結合できる電子を4つ持っているので、4つの結合ができる。
炭素の周りには4つの結合ができる。炭素は4本の腕を持つと説明される。すべて水素と繋がるとCH4(メタンガス)となる。4本の腕は、等方的に広がるので、正四面体の中心に炭素原子核があると、その正四面体の頂点に、結合相手の水素や官能基などが配置される。右図は、炭素Cの周りに4つの結合がある様子を表しており、実線が紙面と同じ平面上にある。黒い▲で表す腕は手前に伸びている。点線で示す△は奥に伸びていることを示している。
炭素同士が連続的につながることが多い。炭素だけを描くことを有機物の炭素骨格いう。炭素の周りは、水素が結合している。
まっすぐ炭素がつながることを直鎖という。
1つがメタン
2つがエタン
3つがプロパン
4つがブタン
5つがペンタン
4つまっすぐ連なった炭素と水素の結合したものをブタンという。4つ以上の炭素が結合する場合には、枝分かれしたものもあり、直鎖の炭素骨格と分けて考えることもある。炭素同士の結合は固定されず回転する。
自然の油脂は、一般に長い直鎖の炭素骨格をもつ。加水分解して、-COOHで表されるカルボン酸を一つ持つものを、脂肪酸という。 CH4
CH3CH3
CH3CH2CH3
CH3CH2CH2CH3
構造異性体。直鎖に対して枝分かれ構造があり、例えば3つの炭素を持つプロパンの真ん中の炭素に一つのメチル基がついたものがある。プロパンにメチル基がついているので、これをメチルプロパンと呼ぶ。また、枝分かれのことをイソといい、上記をイソブタンとも呼ぶ。1つの物質に対して命名法は1種類とは限らないことに注意すること。天然由来成分は、慣習的な名前がついている場合が多い。
4) 揮発性
嗅覚で匂いを感知するのは、空気中に漂っている分子です。そのためにおい分子には、ある程度の揮発性が必要です。有機物を構成する元素の中で、水素H,炭素C,窒素N,酸素O,リンP,硫黄S,塩素Clの7つが常温で揮発性のある物質の構成元素となります。生体中では、リンの大部分はリン酸塩やリン酸エステルとして存在し、塩素は塩化物イオンとして存在します。そのため揮発性を持ちません。したがって、水素H,炭素C,窒素N,酸素O,硫黄Sの5元素がにおい物質の構成元素です。
有機物質の分子の揮発性は分子量が大きくなると低下していくので、分子量350程度、炭素数で20程度がにおいをもつ上限です。
「ノートの分類」
CITRUS(レモン、ベルガモット、マンダリン、スイートオイル、ライム、グレープフルーツ)
WOODY
SPYCY(1)
SPYCY(2)
ORANGE FLOWER
ANIS
ROSE
RUSTIC & CAMPHORT
BALSAM & AMBER
FLORAL
RESIN
CITRONELLA
MINT
5) 二重結合
電子に富んだ結合。炭素同士の距離も短い。炭素の4つの電子のうち二つを使った結合。炭素同士の結合が強く、単結合が回転できる自由な結合なのに対して二重結合は固定的である。
右図のように二重結合は平面で固定される。二重結合を含むと「アルケン」類。特に脂肪酸の場合、二重結合を含むものを不飽和脂肪酸という。
二重結合を含まない炭素同士の有機物を「アルカン」類という。特に脂肪酸の場合、飽和脂肪酸と呼ぶ。それに対して不飽和脂肪酸は二重結合部分が自然に空気中で酸化されて単結合になるので、劣化しやすい。
三重結合を含むものは「アルキン」類という。
6) 二重結合の立体化学(アルケンの化学)
平面的な配置をとるため、その位置によって別の性質をもつ。
右図のような配置をシス型という。同じ側にR基がついているのでストレスが大きい。取りにくい構造。Rは、炭素の集まった官能基を省略して示す記号である。
二重結合の左右でななめに主要骨格があるアルケンのことをトランス型という。より安定な構造。シス型とは化学的性質が異なる。
例えば、レモンの香り成分であるネラールと(シス)とゲラニアール(トランス)は異性体関係にあります。わずかに香りが違いますが、よく似た性質を持っています。
7) 光学異性体
炭素の4つの腕にそれぞれ異なる4種類の官能基があると光学異性がある。そうした炭素をキラルな状態という。光学異性体は、左右の手に対応して、鏡像の関係(鏡に映ったもの同士)にある。LとRと呼ばれ、自然界にはなぜか片方しか存在しない。化学合成だと両者の混合物が出来る場合が多い。L型が有益でもR型は毒性を持つことが多い。光学異性体を作り分ける有機合成でノーベル賞が授与されている。
光学異性体1 光学異性体2(鏡像の関係になっている)
8) 官能基
においに大きく作用する部分。分子のパーツ。骨格炭素に付いて性質を変えるパーツ。
炭化水素とよばれる化合物の骨格は弱く薄い香りで、したに示す官能基と呼ばれる原子団がつくことで香りの特徴と強さがでます。
炭化水素プラス
エーテル、ケトン、アルデヒド、アルコール、フェノール、酸、エステル
におい物質が、個々のにおい分子受容体に結合することでにおいが検知される。その際の、におい物質受容体に結合するかしないかに最も大きく影響するのは、官能基である。におい分子受容体はタンパク質であるので、静電的な力や水結結合によってにおい物質と相互作用していると考えられている。そのため分子の中の官能基が受容体と相互作用すれば、強く結合して、特徴的な匂いがするようになる。
官能基が共通して、ある程度、分子骨格が似ている分子は類似したにおいをもっていることが多い。
一般的には、香りの成分のうち、特に、酸素が含まれる官能基が匂いの特徴を決める。
エーテル:炭素―炭素間の鎖の間に酸素が入った化合物。
1, 8シネオール(ユーカリの香り)
ローズオキサイド(ローズのトップノート)
ヒドロキシル基。アルコールの性質を示す官能基。ヒドロキシル基をもつ物質は、水に溶けやすい傾向がある。 ―OH
エタノールC2H5OHは、CH3CH2OHとも書く。二つの炭素骨格に対してヒドロキシル基が一つ結合したもの。
炭素数1から6と増えるにつれて
メタノール
エタノール
プロパノール
ブタノール
ペンタノール
ヘキサノール
と命名する。
ヘキサノールが芝を刈ったばかりの匂い。
酸化されてアルデヒド(ヘキサナール)になると油臭い草の匂い。
さらに酸化されてカルボン酸(ヘキサン酸)になると、古い油のような匂いを持つ。 CH3-OH
CH3CH2-OH
CH3CH2CH2-OH
CH3CH2CH2CH2-OH
CH3CH2CH2CH2CH2-OH
エチルアルコール
エタノール(酒の成分)
グリセリン
ヒドロキシル基が3つ結合している、3価のアルコール。
石鹸を作るけん化の過程で生成せれる副産物。水にいくらでも溶ける。無色で粘性の大きい、やや甘味のある液体で吸湿性がある。
3級アルコール:
炭素骨格に枝分かれがあり、水酸基(ヒドロキシル基)がついた炭素のほかの結合がすべて炭素と結合しているもの。3級アルコールの例は、リナロール(フローラルグリーン)、α-ターピネオールやターピネン4オール(ややミント様のフローラル香気)
H
O
C-C-C
C
CH3CHOはアセトアルデヒド。
H3CCHO
アルデヒド基。匂いがアルコールとは異なり、油臭い草のような匂いになる。酸化されやすく、周りを還元する還元剤。代表例は、レモンのシトラール(ネラールとゲラニアールの混合体)。
カルボキシル基
カルボン酸という酸の仲間。油の腐った匂いがすることが多い。
CH3COOHが酢酸。お酢の成分。
HCOOHはギ酸。蟻の毒の成分。
酸の香りは、アップルやマスカットなどフルーツの香りとして重要。
アミノ基。NH3がアンモニア。アンモニア臭といわれる異臭がする。
ケトン R-CO-R’
アセトンは、無色で香りのある液体で、水にいくらでも溶ける。また有機溶剤としてもいろいろな有機物を溶かす。ケトンの代表。
エステル。酸とアルコールから生じる。
―CO-O-結合をエステル結合といい、分子量の小さいものは、良い香りをもつ。果実の香りの主成分である。日本酒の吟醸香やバナナの香りなどが特徴的。
酢酸リナリル(ラベンダーやクラリーセージ)
酢酸ベンジル(ジャスミン)
R―C-O-R
エステル結合を持っているとフルーティな香りがする。
カルボン酸とアルコールが反応してエステルになる。
エステルを塩基を用いて分解することを「けん化」という。
エステルの一種である油脂を塩基を用いてけん化すると石鹸ができる。
nアミルアセテート。バナナの香りがする。エステル結合が入っている代表的な分子。酢酸アミル(Amyl acetate)あるいはエタン酸ペンチル、分子量130.18 g/molのエステルに区分される有機化合物である。バナナやリンゴに似た臭いを持つ。
9) ベンゼン環・シクロアルカン
炭素が6個、平面的に環状につながった構造で、6つの炭素それぞれの4つの腕(電子)のうち3つが環状構造の形成に使われている。1つの炭素は両隣の炭素と結合しているので、片方1つの炭素との結合にはが1.5本の腕(1.5個ずつの電子)を出して結合していることになる。単結合(1個ずつの電子を出し合っての結合)よりも電子に富む結合である。正確には、それぞれの炭素間で1個本ずつの電子を出し合って結合していることに加えて、6つの炭素それぞれから1個ずつ、計6つの電子を環全体で共有している。(つまり、特定の炭素間に二重結合があるのではない)。ベンゼン環は安定な性質をもつ。
省略して書くと右図の記号になる。六角形の真ん中に〇を描いたもの。
ベンゼン環に対して、全てが単結合でつながった環状の化合物をシクロアルカンと呼ぶ。シクロアルカンは平面的ではなく、一つひとつの炭素は4つの腕を出し、正四面体の中央にある。そのためシクロアルカンには立体配位(イス型とフネ型)があり、それは瞬間的に入れ替わっている。化学的な性質は変わらない。立体配位があり、瞬間的に入れ替わっている。化学的な性質は変わらない。イス型は、椅子の形から命名された。
フネ型は船の形から命名された。
イス、フネの立体配位は、シクロアルカンにつく官能基によって異なる。
5員環はやや不安定。4員環、3員環は不安定。
10) ベンゼン環の官能基の位置
ベンゼン環にOH基の結合したものをフェノールと呼ぶ。フェノールにもう一つ官能基が加わる場合の位置は、下図のように3種類ありえる。位置によって性質が異なる。二つの官能基の位置によってオルト、メタ、パラと命名する。
パラ メタ オルト
11) ベンゼン環の官能基
ベンゼン環に官能基がつくと性質が大きく変わる
フェノール
炭素骨格に付く官能基になっている場合は、フェニル基(-O-C6H6)という。フェノールをたくさん含む構造の分子をポリフェノールという。「ポリ」はたくさん連なったものという意味。
ヒドロキシル基がベンゼン環に3つ結合したフェノールの仲間。
安息香酸
カルボン酸の性質とベンゼン環の性質を併せ持つ
12) 酸化還元反応
ヒドロキシル基は酸化されやすい。 -OH
エタノール。(CH3CH2OH)お酒の主成分。飲むと水の分子と同じく脳の血管に届き、酔う。
アルコール酸化されるとアルデヒド(-CHO)になる。アルデヒドは独特のにおいがある。
さらに酸化が進むとカルボン酸(―COOH)になる。カルボン酸は、腐った油の匂い。
サリチルアルコールはフェノール基ではなく、アルコール基が酸化されてやすい。官能基の-CH2OH部分が酸化されて-COOHとなってカルボン酸になる。
サリチル酸は湿布薬の基本材料で非常に有益。
ベンゼン環に対して―OHと―COOHが官能基として結合している。サリチル酸は冷水に溶けにくいが,温めると溶けるようになる。フェノールよりも親水性の効果が大きいと考えることができます。また,サリチル酸の水溶液は酸性である。
低級脂肪族エステル(低級脂肪酸カルボン酸と低級脂肪酸アルコ―ルから成るエステル
例)酢酸エチル:フルーティなにおい
芳香族エステル
芳香族アルコールとのエステルで脂肪族エステルとは匂いが大きく異なる。
例)酢酸ベンジル:ジャスミンのような匂い。(芳香族アルコール系)
桂皮酸メチル:まつたけのような匂い。(芳香族カルボン酸系)
13) 天然由来香料
天然由来におい物質は、生体内でどのように作られるかによっても分類される、この分類で同じカテゴリーに属する物質は、原料や経路が共通しているため、骨格にも共通性がある。
テルペン化合物は、香りを持つ化合物のなかで最も重要なもので、ほとんどの植物の香りがはテルペン類が元になっています。テルペン類はイソプレンのつながり方によって複雑な立体構造が作られて、香りのタイプもさまざまに異なります。
テルペン類(テルペノイド)
イソプレン(isoprene)は構造式CH2=C(CH3)CH=CH2の、二重結合を2つ持つ炭化水素。分子量 68.12、融点 −145.95 ℃、沸点 34.067 ℃。室温では揮発性の高い無色の液体で、ゴムもしくは都市ガス様の臭気を持つ。炭素数が5。
テルペン類はイソプレンの構造をが2,3,4個持つ分子のグループ。テルペノイドといい、炭素数5の倍数の炭素を含んでいる。なあkでも炭素数10のモノテルペン。炭素数15のセスキテルペンと呼ばれる分子グループが特に重要である。 2つイソプレンが集まってモノテルペン類。
3つでセスキテルペン類。
4つでジテルペン類。
テルペノイドは炭素数が決まっているため、比較的揮発性が近い。したがって、モノテルペンは、トップからミドルノートに大きく寄与する。それに対して、分子量の大きなセスキテルペンは、ミドルノートからラストノートに寄与する。 モノテルペン
分子量:小さい
揮発性:高い(蒸発しやすい)
におい:トップノートからミドル
d-リモネン
レモンの香りの主成分の分子。単環式モノテルペノイドの一種。分子量は136.23。 天然にはd体、l体、d/l体の三種類が存在する。d体は、柑橘類の果皮に多く含まれ、その香りを構成する物質の一つである。二重結合を二つ有し、酸化されやすい。l体はハッカ油に含まれ、d/l体はテレビン油等に含まれる。いずれも香料としての用途があり、合成も行われている。
シオネール: ユーカリに代表して香草に含まれる。環状エーテル構造を持つモノテルペノイドの一種である。
ゲラニオール。
薔薇のような香り。 geraniol はゼラニウムから発見された直鎖モノテルペノイドの一種。主にローズオイル、パルマローザ油、シトロネラ油に含まれる。また、ゼラニウムやレモン、いくつかの精油にも含まれている。無色または薄い黄色の液体で、水には溶けないが多くの有機溶媒には溶ける。バラに似た芳香を持ち、広く香水に使われている。また、モモ、ラズベリー、グレープフルーツ、リンゴ、プラム、ライム、オレンジ、レモン、スイカ、パイナップル、ブルーベリーのような芳香としても用いられる。
l―メントール。ペパーミントの葉に含まれている。清涼感を与える。ハッカ臭を持つ、揮発性の無色結晶である。 l-メントールは歯磨きやチューインガムなどの菓子類、口中清涼剤などにタヨウサレルほか、局所血管拡張作用、皮膚刺激作用等を有するため、医薬品にも用いられる。
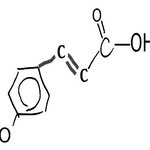
クマル酸Coumaric Acid
p-クマル酸が天然に最も多く存在する。
p-クマル酸は、ピーナツ、トマト、ニンジン、ニンニクなどの食用植物中にも広く含まれている。結晶性で固く、水にはわずかしか溶けないが、エタノールやジエチルエーテルには良く溶ける。
p-クマル酸には酸化防止剤の効果がある。
o-クマル酸は配糖体として植物に存在し、これが分解すると閉環してクマリン(桜の葉などの香り)となる。
14) 炭素以外の香りを持つ分子
オゾン。酸素の仲間。同素体という。3つの酸素原子が分子を形成する。オゾン臭という雷の匂いがする。
アンモニア。窒素に3つの水素が結合したもの。
炭素が4つの腕があるのに対して、窒素は3つの腕がある。残りの電子は対になっていて結合には関与しない。
以上、お疲れ様でした。